纤细裸藻(Euglena gracilis)是一种重要的光合经济微藻,能够合成β-胡萝卜素、副淀粉、维生素和脂肪酸等高附加值产物。2013年,我国国家卫计委根据有关法律规定,将纤细裸藻列为新食品原料,是继雨生红球藻(Haematococcus pluvialis)和蛋白核小球藻(Chlorella pyrenoidosa)等又一种合法的食品微藻,具有重要的科研和经济价值。此外,基因编辑技术在实现纤细裸藻化工、能源、医药和环境等合成生物学领域的规模化应用起着重要作用,该技术与10-20 μm级单细胞微藻显微注射法相结合,可大幅度提升纤细裸藻基因编辑成功率和效率。
nb88新博客户端首页王江新教授团队,从2014年初起就开始研究裸藻的基因编辑,聪明勤奋的博士后和研究生们,来了又走了,花开花谢,我们尝试了所有常用的转化方法和不同的基因编辑酶(Cpf1, Cas9等)但都失败了。经过漫长的八年默默探索,不懈努力,近期终于取得突破!

近日,团队成员陈振帆博士终于在国际权威期刊《植物生物技术》(Plant Biotechnology Journal,中科院一区Top,IF:13.263) 上发表了一篇题为“High-throughput sequencing revealed low-efficacy genome editing using Cas9 RNPs electroporation and single-celled microinjection provided an alternative to deliver CRISPR reagents into Euglena gracilis”的通讯研究论文。该研究通过高通量测序结果揭示了电转化法难以实现纤细裸藻CRISPR高效基因编辑,其编辑效率低于1%且无法获得突变株(图1f),而此前2019年日本学者报道了通过电转获得了接近80%的超高编辑效率,此惊人的结果目前为止,不仅我们课题组无法重复,世界上也尚无其他实验能重复。我们采用10-20 μm单细胞显微注射法则可以直接地将CRISPR基因编辑等药物递送入纤细裸藻细胞内,其效率高达16.7%,并获得了靶向PDS基因的crtP1裸藻突变株(图1 g和h)。nb88新博客户端首页陈振帆博士后为论文第一作者,王江新教授为论文通讯作者,nb88新博客户端首页为唯一完成和通讯单位。上述研究得到了国家科技部重点研发计划合成生物学专项项目(2018YFA0902500, 2020YFA0908703, 2021YFA0910800)支持。
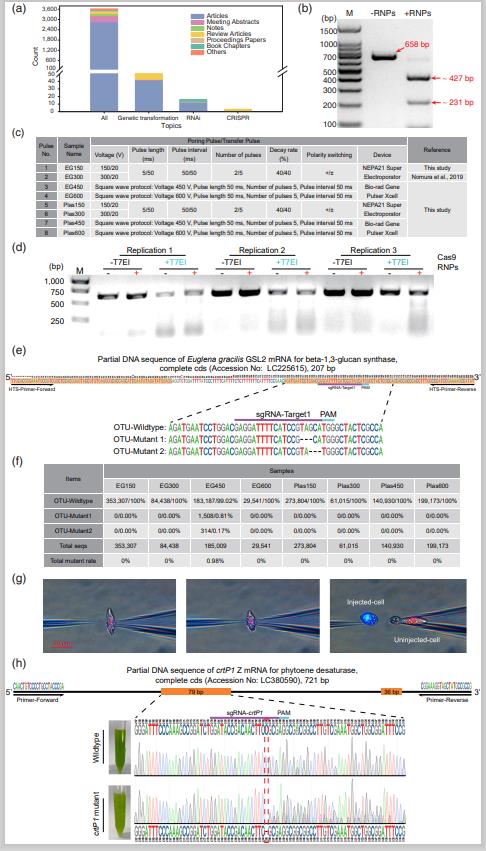
图1 基于CRISPR电转化和单细胞显微注射法的纤细裸藻基因编辑
近些年,基因编辑技术CRISPR/Cas9 (clustered regularly interspaced short palindromic repeats/CRISPR-associated proteins)是生命科学领域一项具有革命性的技术,被广泛运用于多种动植物基因组基因的敲除(knock out)和敲入(knock in)。然而,多数单细胞微藻基因编辑和遗传转化的实现依旧十分困难。单胞藻细胞之所以比动物细胞难实现基因编辑或者遗传转化,可能是由于外源物质不易递送进入胞内所致(电转法),若不采用抗性筛选将难以获得突变株。因此,陈振帆博士和王江新教授研究团队采用单细胞微藻显微注射法,第一次成功实现了将CRISRP/Cas9等大分子外源物质递送入纤细裸藻细胞内并实现基因编辑。在单细胞微藻生物技术领域,单细胞基因编辑、单细胞遗传转化和单细胞合成生物学等方向的研究几乎都是空白。
在未来,单细胞操控技术将有可能进一步助力提升单细胞微藻的基因工程改造转化效率和成功率。王江新教授课题组期望与同行一起合作,在其他的经济微藻如雨生红球藻、盐藻等,以及难以转化的重要经济作物中进行相关的无痕基因编辑改良。


